В мире химии существует множество удивительных соединений, которые привлекают внимание своей особенной структурой и свойствами. Одним из них является лигандометаллическое соединение, известное также как лигандный метал комплекс. Наши глаза с удивлением замирают перед его запутанными образами.
В основе этого многообещающего соединения лежит взаимодействие лиганда и металла. В отличие от классической ионно-связанной структуры, в которой ионы просто притягиваются к друг другу силами электростатического взаимодействия, лигандометаллическое соединение находится на совершенно другом уровне. Здесь между лигандами и металлом существуют прочные и своеобразные связи, обеспечивающие устойчивость и уникальные свойства соединения.
Одним из наиболее захватывающих примеров лигандометаллических соединений является соединение, получаемое путем комбинирования лития и хлорида, которое называется Литий-хлорид (LiCl). Взаимодействие этих двух элементов дает возможность получить сложные структуры с уникальными свойствами. Литий-хлорид относится ко второй группе периодической системы, что позволяет ему образовывать множество соединений с другими элементами. Каждое из них имеет свои особенности, которые в большей степени обусловлены пространственными расположениями молекул и межатомными взаимодействиями.
Особенности взаимодействия атомов лития и хлора в соединении LiCl

Раздел будет посвящен изучению специфических особенностей химической связи, которая возникает между атомами лития и хлора в соединении LiCl.
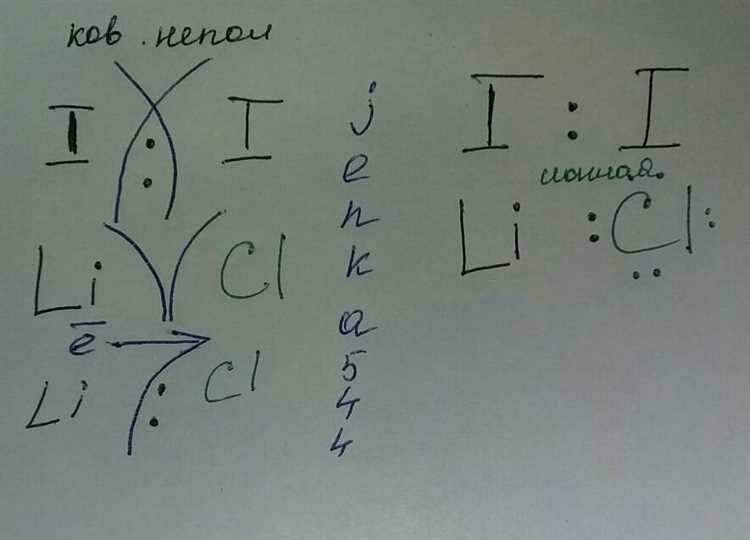
Взаимодействие атомов в данном соединении происходит благодаря образованию электронно-валентной связи. Атом лития, обладая одним валентным электроном, осуществляет его передачу на атом хлора, который, в свою очередь, обладает семью валентными электронами во внешнем электронном слое. Таким образом, образуется ионная связь между положительно заряженным ионом лития Li+ и отрицательно заряженным ионом хлора Cl-, что обеспечивает стабильность соединения.
Взаимодействие атомов лития и хлора характеризуется сильной электроотрицательностью хлора, что влияет на распределение зарядов в соединении. Также следует отметить, что LiCl обладает высокой кристаллической решеткой и гигроскопичностью, что позволяет использовать его в различных областях, таких как производство лекарственных препаратов, синтез органических соединений и технологии оксида лития.
Тема химической связи в соединении LiCl относится к области химических исследований и научного прогресса, а углубленное изучение особенностей этой связи имеет большое значение для практического применения соединения LiCl в различных областях науки и промышленности.
Особенности и возможности применения соединения Licl в химической сфере
Данная статья посвящена изучению Licl — вещества, обладающего уникальными свойствами и представляющего большой интерес для химической науки и промышленности.
- Аспекты химической связи: изучение молекулярных связей и их роли в структуре Licl.
- Физические свойства: разбор физических характеристик соединения, таких как плотность, температурные условия и растворимость.
- Химические свойства: рассмотрение реакционной способности Licl и его взаимодействия с другими веществами.
- Аналитические методы: описание методов исследования и анализа Licl, используемых в химической аналитике и исследовательской работе.
- Применение в промышленности: представление различных областей применения соединения Licl в производстве химических реактивов, фармацевтике, электронике и других сферах.
- Безопасность: рассмотрение мер предосторожности при работе с Licl и его воздействии на окружающую среду.
Проведение подробного анализа Licl позволяет лучше понять его химическую природу и применение в различных областях науки и промышленности. Изучение особенностей соединения и его связи с другими веществами открывает новые перспективы для разработки инновационных технологий и материалов.
Ковалентное взаимодействие в структуре LiCl
В данном разделе рассмотрим основные аспекты ковалентной связи, которая присутствует в структуре соединения LiCl. Ковалентная природа данной связи определяется взаимодействием электронов валентных оболочек лития и хлора, что приводит к образованию устойчивой кристаллической структуры.
Особенностью ковалентной связи в LiCl является равное распределение электронной плотности между атомами лития и хлора. Это означает, что оба атома участвуют в образовании связи и делят между собой пару электронов. Такое взаимодействие обуславливает прочность и стабильность структуры LiCl.
Ковалентная природа связи в LiCl находит широкое применение в различных областях. Так, данный материал может использоваться в производстве литиевых батарей, термоэлектрических устройств, а также в производстве фармацевтических препаратов и синтезе органических соединений.
- Равномерное распределение электронной плотности между атомами лития и хлора обуславливает стабильность структуры LiCl.
- Ковалентная связь в LiCl подразумевает обмен электронами между атомами, что обеспечивает прочность связи.
- Применение LiCl в различных отраслях, включая производство литиевых батарей и фармацевтических препаратов.
Роль и значимость LiCl в химических соединениях: вариативное применение на практике

Обширные исследования подтверждают, что химический элемент, представленный бинарным соединением LiCl, обладает широким спектром свойств и способностей, что придает ему высокую значимость в различных областях. Это многофункциональное соединение характеризуется своими уникальными химическими особенностями, которые позволяют ему находить применение в разнообразных технологиях и процессах.
- Соединение LiCl используется в фармацевтической промышленности, где оно служит основой для создания ряда лекарственных препаратов. Благодаря своему способству развитию стабильности и сокращению процентов побочных эффектов, ЛиЦл позволяет достичь высокой эффективности при производстве множества лекарственных субстанций.
- В промышленности употребляют соединение, чтобы справиться с влагой, влияющей на различные объекты и процессы производства. Благодаря его способности поглощать влагу и превращаться в гидратную форму, LiCl помогает укрепить конструкцию или предотвратить коррозию важных деталей и повысить их долговечность.
- В химической промышленности LiCl демонстрирует свою эффективность в качестве катализатора, обеспечивая активацию реакций и снижение энергозатрат. Применение данного соединения в различных производственных процессах позволяет сократить затраты на энергию и улучшить общую производительность.
- Несомненную роль играет соединение LiCl и в электронике. В частности, оно служит основной составляющей электролитов аккумуляторов и суперконденсаторов. Благодаря способности при работе с электропотенциалами быть устойчивым и обладать низкой концентрацией примесей, этот элементарный компаунд способен значительно повысить работоспособность и долговечность аккумуляторных систем.
Наряду с вышеперечисленными применениями, LiCl находит свое применение и в других областях. В дальнейших разделах вы узнаете более подробно о разнообразных особенностях и техническом применении данного соединения, расширив свои знания о его значимости в различных отраслях промышленности и научных исследованиях.
Ионная природа связи в хлориде лития

В данном разделе мы рассмотрим основные черты и особенности ионной природы связи, характерной для хлорида лития.
- Ионная связь – это тип химической связи, возникающей между атомами, когда один атом отдает электрон(ы), а другой атом принимает электрон(ы), образуя положительный ион и отрицательный ион соответственно.
- В хлориде лития (LiCl) ионная связь образуется между литием и хлором. Литий отдает один электрон, становясь положительно заряженным ионом Li+, а хлор принимает этот электрон, образуя отрицательно заряженный ион Cl-.
- Кристаллическая структура хлорида лития обусловлена присутствием ионной связи. Позитивно и отрицательно заряженные ионы Li+ и Cl- притягиваются друг к другу, образуя упорядоченную решетку.
- Ионная связь в хлориде лития обладает высокой прочностью и температурной стабильностью, что делает этот соединение полезным в различных областях, включая применения в электронике, химической промышленности и фармацевтической продукции.
- Важно отметить, что ионная природа связи в хлориде лития обусловливает его растворимость в воде и других полярных растворителях. Когда хлорид лития растворяется, ионы Li+ и Cl- разделяются и образуют оболочки гидратации, окруженные молекулами воды.
Таким образом, ионная связь в хлориде лития проявляется во многих аспектах его структуры и свойств, что делает это соединение важным объектом изучения в химии и науке о материалах.
Основные свойства и применение соединения LiCl
- Химическая активность соединения.
- Физические свойства LiCl.
- Взаимодействие соединения с водой и другими растворителями.
- Влияние LiCl на образование других соединений.
- Применение LiCl в различных отраслях науки и промышленности.
- Роль LiCl в электрохимических процессах.
- Воздействие LiCl на физиологические системы.
Изучение свойств и применение соединения LiCl позволяет раскрыть его потенциал в различных областях науки и техники. Более глубокое понимание характеристик этого соединения способствует разработке новых методов и технологий, а также улучшению существующих процессов и систем в разных отраслях деятельности.
Применение в различных отраслях

В данном разделе рассмотрим разнообразные области, в которых соединение LiCl находит применение. Благодаря своим уникальным свойствам, оно выступает в роли важного компонента во многих отраслях промышленности и науки.
В одной из сфер применения LiCl является сельское хозяйство. Благодаря своим связующим свойствам, соединение способствует увеличению урожайности, а также обеспечивает безопасность и защиту семян и растений от вредителей.
В контексте медицины, LiCl используется в разработке препаратов, которые обладают антисептическими и противовоспалительными свойствами. Также, соединение может применяться в фармацевтической промышленности для синтеза лекарственных препаратов и создания вакцин.
В энергетической отрасли LiCl проявляет свою эффективность как электролит в батареях, а также используется в некоторых процессах очистки и поверхностной обработке металлов.
Благодаря среде, создаваемой LiCl, данное соединение также применяется в процессах экстракции редких металлов и промышленном разведении.
Отражаясь в различных отраслях промышленности и науки, LiCl смог выйти за рамки обычного определения и стать неотъемлемым элементом успешного развития многих отраслей. И его роль в них по-прежнему остается самым ценным и необходимым.
Физические свойства и уникальные характеристики соединения на основе Li и Cl элементов

В данном разделе мы рассмотрим физические свойства и интересные особенности соединения, основанного на элементах Li и Cl. В химии мы часто сталкиваемся с тем, как элементы соединяются, образуя различные химические соединения. Однако некоторые соединения имеют свои особенности и интересные свойства, которые заслуживают особого внимания.
Одной из уникальных особенностей данного соединения является его высокая растворимость в воде. Это значит, что LiCl хорошо растворяется в воде и образует стабильные растворы. Благодаря этой особенности, соединение на основе Li и Cl элементов находит широкое применение в различных областях науки и промышленности.
Ещё одной интересной характеристикой данного соединения является его способность к образованию кристаллической структуры. Кристаллическая структура обусловлена упорядоченным расположением атомов в решетке соединения. Это придает соединению определенные физические и химические свойства, такие как прочность и твердость.
Также следует отметить, что LiCl является электролитическим соединением. Это означает, что оно способно проводить электрический ток в растворе или при плавлении. Интересно, что в растворе LiCl дает положительные и отрицательные ионы, что делает его полезным в ряде электрохимических процессов и при создании электролитических решений.
Таким образом, соединение на основе Li и Cl элементов обладает рядом уникальных физических и химических свойств, которые находят свое применение в различных областях. Растворимость в воде, кристаллическая структура и электролитические свойства делают это соединение значимым для множества научных и практических целей.
Вклад Licl в фармацевтическую промышленность
Одной из основных областей использования Licl в фармацевтической промышленности является его роль в процессе синтеза различных медицинских препаратов. За счет своей способности образовывать стабильные связи с другими соединениями, Licl может служить важным компонентом в реакциях, направленных на получение целевых продуктов. Это особенно актуально в задачах создания инновационных лекарственных средств, где Licl может быть ключевым фактором для достижения желаемого результата.
Другой важной областью применения Licl является его роль в качестве катализатора реакций. Благодаря своей структуре и свойствам, Licl способен активировать определенные реагенты, находящиеся в органических смесях, и ускорять реакции, особенно в условиях, близких к физиологическим. Это открывает новые возможности для создания более эффективных и безопасных фармацевтических препаратов, включая инновационные технологии доставки лекарственных веществ.
| Применение Licl в фармацевтической промышленности | Преимущества и результаты |
|---|---|
| Синтез лекарственных препаратов | Обеспечение эффективности и качества продукции |
| Катализатор реакций | Улучшение скорости и эффективности процесса синтеза |
Основные свойства и области применения соединения Licl
В данном разделе мы рассмотрим особенности и важные характеристики соединения Licl, а также расскажем о его широком спектре применений в различных областях.
- Высокая растворимость: Licl обладает высокой растворимостью в воде и многих органических растворителях, что делает его удобным для использования в химических реакциях и синтезе различных соединений.
- Анион-сообразователь: Соединение Licl может служить анион-сообразователем во многих химических реакциях, способствуя образованию комплексных соединений и соединений с сильными явлениями кристаллической солеватки.
- Физиологическое воздействие: Имея низкую токсичность и способность смягчать жесткую воду, Licl находит свое применение в медицине, фармацевтике и косметической промышленности.
- Электролитические свойства: Соединение Licl является сильным электролитом, обладая способностью распадаться на ионы Li+ и Cl- при растворении, что находит свое применение в электрохимических процессах и электролизе.
- Применение в аналитической химии: Licl используется в качестве реактива и стандартного вещества для анализа других соединений методами, такими как хроматография, спектроскопия и другие аналитические методы.
Таким образом, соединение Licl является многофункциональным веществом, которое находит применение в различных областях науки и промышленности благодаря своим уникальным свойствам и возможностям.
Использование в электрохимии
В электрохимии, одной из важных и прогрессивных областей современной науки и промышленности, регулярно встречается использование соединения, обладающего особыми свойствами и применимостью. Это вещество, носящее название, неодушевленно взаимодействующих частиц, может быть найдено в неожиданных местах и использовано в различных электрохимических процессах.
- Первое важное применение этого соединения заключается в его использовании в качестве электролита, то есть вещества, способного проводить электрический ток. Благодаря своим уникальным свойствам, указанное вещество успешно выполняет роль электролита и позволяет проводить электролиз различных веществ.
- Также это соединение широко применяется в электрохимических гальванических элементах. Благодаря своей способности производить электродную реакцию, оно может быть использовано в качестве активного материала в батареях, аккумуляторах и других источниках энергии.
- Другим применением этого вещества в электрохимии является его использование в качестве катиона при осаждении металлов на электроде. В ходе электрохимического осаждения, оно позволяет контролировать процесс нанесения металлического покрытия, обеспечивая необходимую прочность и защиту.
Таким образом, соединение, рассмотренное в данном разделе, играет важную роль в электрохимии и находит широкое применение в различных процессах. Его уникальные свойства и возможности делают его незаменимым инструментом в области электрохимии, способствуя развитию новых технологий и достижению новых высот в научных исследованиях и промышленности.